醫療器械的生命周期涉及多個階段,其中包括醫療器械的設計研發、原材料采購、生產及檢驗、臨床試驗、產品注冊、上市后臨床使用、經營與銷售、以及最終停用和廢棄處置等,可吸收醫療器械也不例外,大致可如下圖所示:
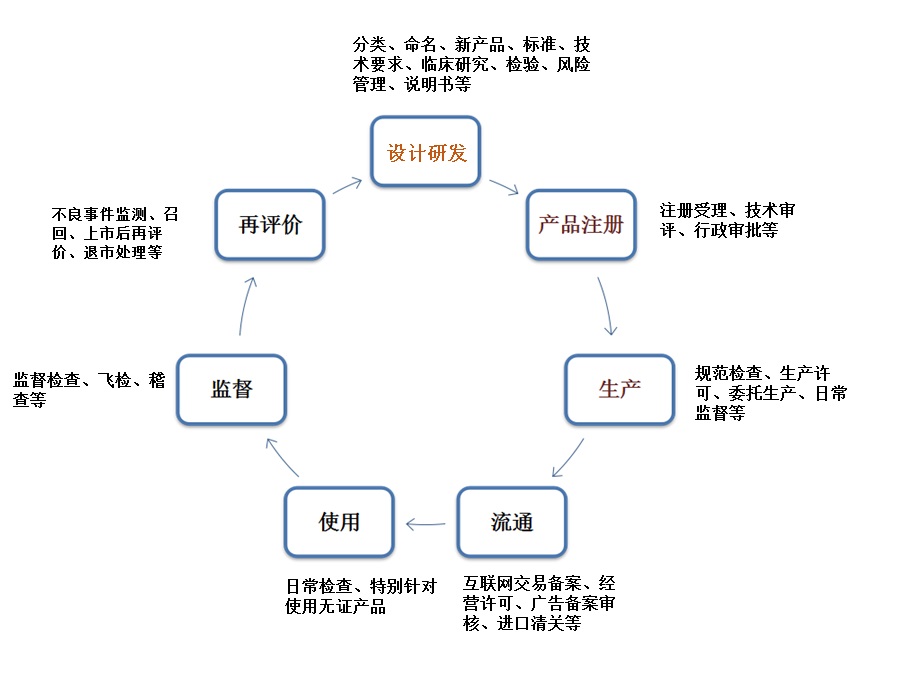
因此,關于可吸收醫療器械的監管可從這些階段開展進行,針對這些不同階段,CFDA也出臺了相應的法規。具體詳見下表:
階段 | 法規/標準名稱 | 實施日期 |
設計研發 | YY/T 0316-2016《醫療器械 風險管理對醫療器械的應用》 | 2017-01-01 |
《醫療器械分類規則》 | 2016-01-01 | |
《醫療器械通用名稱命名規則》 | 2016-04-01 | |
《醫療器械說明書和標簽管理規定》 | 2014-10-01 | |
《醫療器械注冊管理辦法》 | 2014-10-01 | |
生產和檢驗 | 《醫療器械生產監督管理辦法》 | 2014-10-01 |
《醫療器械生產企業供應商審核指南》 | 2015-01-19 | |
《醫療器械生產質量管理規范》 | 2014-12-29 | |
《醫療器械生產企業質量控制與成品放行指南》 | 2016-12-30 | |
《醫療器械生產質量管理規范——無菌醫療器械現場檢查指導原則》 | 2015-09-25 | |
《醫療器械生產質量管理規范——植入性醫療器械現場檢查指導原則》 | 2015-09-25 | |
YY/T 0287-2017《醫療器械 質量管理體系 用于法規的要求》 | 2017-05-01 | |
臨床試驗和 臨床使用(上市后) | 《醫療器械臨床試驗質量管理規范》 | 2016-06-01 |
《醫療器械不良事件監測和再評價管理辦法(試行)》 | 2008-12-29 | |
《醫療器械不良事件監測工作指南(試行)》 | 2011-09-16 | |
流通使用、監督抽查 | 《醫療器械經營監督管理辦法》 | 2014-10-01 |
《醫療器械經營質量管理規范》 | 2014-12-12 | |
《醫療器械使用質量監督管理辦法》 | 2016-02-01 | |
《醫療器械經營質量管理規范現場檢查指導原則》 | 2015-10-15 | |
《醫療器械召回管理辦法》 | 2017-05-01 | |
《醫療器械廣告審查辦法》 | 2009-05-20 | |
《藥品醫療器械飛行檢查辦法》 | 2015-09-01 | |
《醫療器械網絡銷售監督管理辦法》 | 2018-03-01 |
