對于未列入《免于進行臨床試驗的醫療器械目錄》的醫療器械產品,也可以與同類已上市產品進行比對,通過臨床數據收集及分析評價等資料證明兩者基本等同,從而完成臨評價過程。本文介紹了同品種醫療器械臨床評價的具體要求及評價流程。
1.什么是同品種醫療器械?
同品種醫療器械是指與申報產品在基本原理、結構組成、制造材料(有源類產品為與人體接觸部分的制造材料)、生產工藝、性能要求、安全性評價、符合的國家/行業標準、預期用途等方面基本等同的已獲準境內注冊的產品。其中申報產品與同品種醫療器械的差異不對產品的安全有效性產生不利影響,可視為基本等同。
2.同品種醫療器械的判定
通過同品種醫療器械臨床試驗或臨床使用獲得的數據進行分析評價,證明醫療器械安全、有效。申報產品與同品種醫療器械對比項目如下表:
無 源 醫 療 器 械 | 對比項目 | 有源醫療器械 | 對比項目 |
1.基本原理 | 1.基本原理 (1)工作原理 (2)作用機理 | ||
2.結構組成 | 2.結構組成 (1)產品組成 (2)核心部件 | ||
3.生產工藝 | 3.生產工藝 | ||
4.制造材料(如材料牌號、動物源性材料、同種異體材料、成分、藥物成分、生物活性物質、符合的標準等信息) | 4.與人體接觸部分的制造材料(如材料牌號、動物源性材料、同種異體材料、成分、藥物成分、生物活性物質、符合的標準等信息) | ||
5.性能要求 | 5.性能要求 (1)性能參數 (2)功能參數 | ||
6.安全性評價(如生物相容性、生物安全性等) | 6.安全性評價(如生物相容性、生物安全性、電氣安全性、輻射安全性等) | ||
7.產品符合的國家/行業標準 | 7.軟件核心功能 | ||
8.適用范圍: (1)適用人群 (2)適用部位 (3)與人體接觸方式 (4)適應癥 (5)適用的疾病階段和程度 (6)使用環境 | 8.產品符合的國家/行業標準 | ||
9.使用方法 | 9.適用范圍: (1)適用人群 (2)適用部位 (3)與人體接觸方式 (4)適應癥 (5)適用的疾病階段和程度 (6)使用環境 | ||
10.禁忌癥 | 10.使用方法 | ||
11.防范措施和警告 | 11.禁忌癥 | ||
12.交付狀態 | 12.防范措施和警告 | ||
13.滅菌/消毒方式 | 13.滅菌/消毒方式 | ||
14.包裝 | 14.包裝 | ||
15.標簽 | 15.標簽 | ||
16.產品說明書 | 16.產品說明書 |
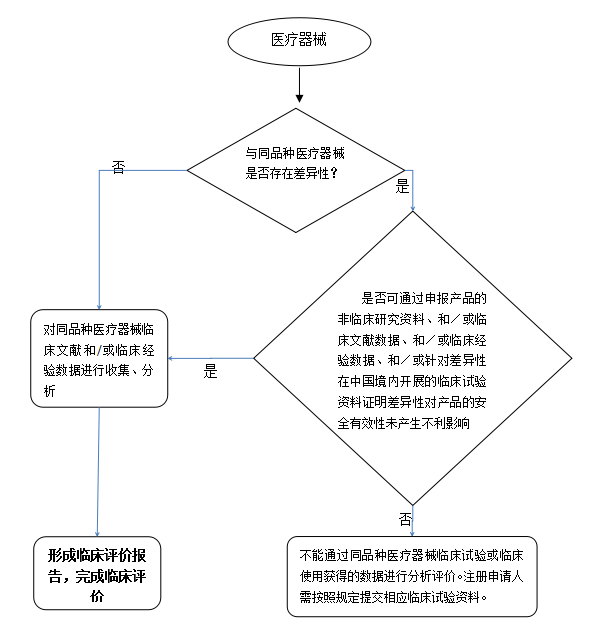
通過上表項目的對比,證明申報產品與同品種醫療器械基本等同,對差異性部分應說明是否對產品的安全有效性產生不利影響,并通過申報產品自身的數據進行驗證或確認,如申報產品的非臨床研究數據、臨床文獻數據、臨床經驗數據或針對差異性開展的臨床試驗數據。
3.同品種醫療器械臨床評價路徑
4.同品種醫療器臨床評價主要收集資料
申報產品 | 同品種已上市醫療器械 |
1. 非臨床研究資料 2. 臨床文獻和未發表的臨床研究資料 3. 投訴和不良事件 4. 與臨床風險相關的糾正措施 5. 中國人群臨床研究數據 | 1. 臨床文獻和已經完成但未發表的臨床研究資料 2. 投訴和不良事件 3. 與臨床風險相關的糾正措施 4. 中國人群臨床臨床研究數據 |
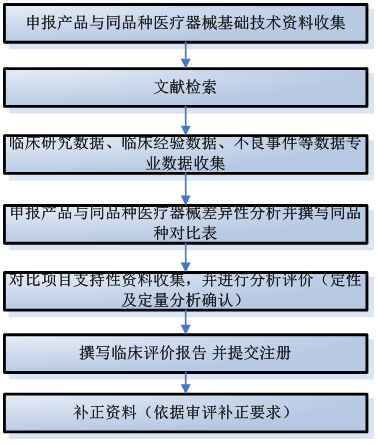
5.同品種醫療器械對比臨床評價流程