伴隨著疫情的發展及返工高峰的到來,通過及時檢測自己的體溫變化、高度警惕發熱,有助于提前發現感染者,體溫計作為疫情應急產品之一,瑞旭集團結合醫療器械法規及體溫計的注冊申報要求總結了體溫計產品的注冊申報過程的技術要求供參考。
依據醫療器械法規,體溫計屬于第二類醫療器械,根據其工作原理的不同可分為紅外體溫計、電子體溫計、玻璃體溫計。
一、體溫計產品概述
1. 紅外體溫計
1.1紅外體溫計結構組成:
通常由紅外溫度傳感器、探頭套、顯示單元、供電電路、測量電路組成。
1.2紅外體溫計工作原理:
自然界中一切溫度高于絕對零度(—273℃)的物體都會輻射出紅外線,而輻射出的紅外線的能量和溫度是正比的關系。利用這種關系,可以通過測量物體的紅外線強度來計算出它的溫度。
1.3 紅外體溫計典型結構:
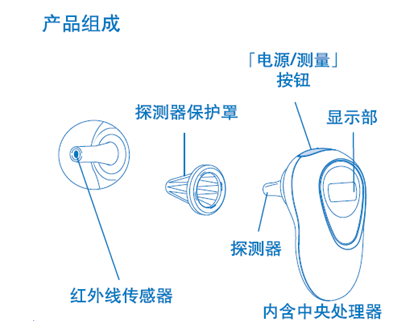
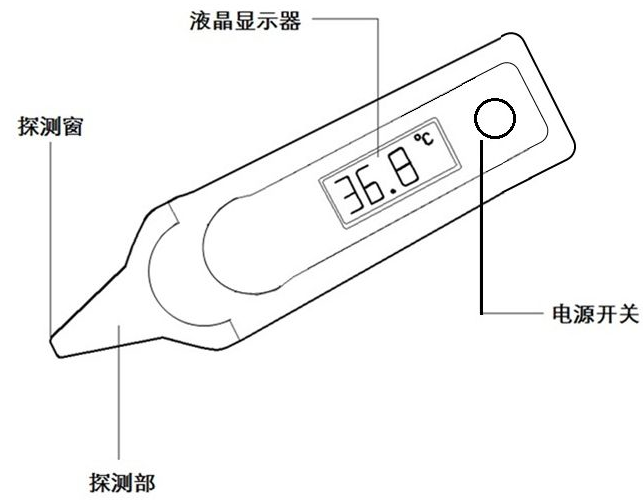
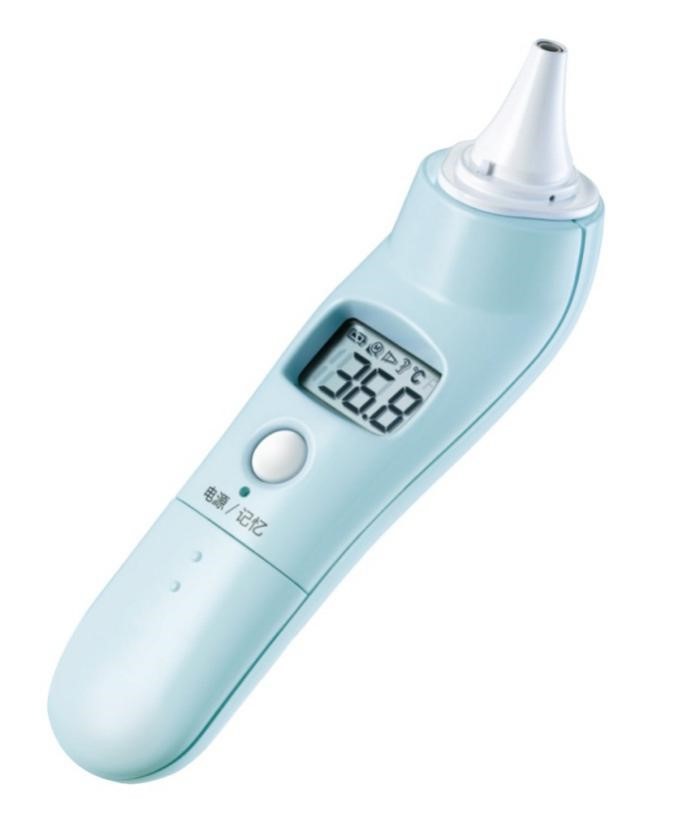
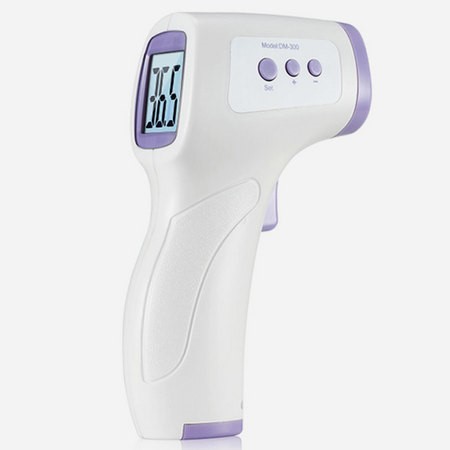
2. 電子體溫計
2.1 電子體溫計結構組成:
一般由探測器(探頭保護套附件)、傳感器、CPU控制模塊、顯示模塊、提示音模塊、電源供應模塊組成。
2.2 電子體溫計工作原理:
放置在測量部分頂端的熱敏電阻作為溫度傳感裝置,當外界被測熱源的溫度發生改變時,熱敏電阻的阻值將隨之改變,內部微處理器對測量回路中熱敏電阻的阻值變化,進行換算、處理、修正后,將測量溫度以數字的形式在顯示屏上顯示出來,同時蜂鳴音響,測量過程結束。
2.3 電子體溫計產品典型結構:
產品結構框圖如下:
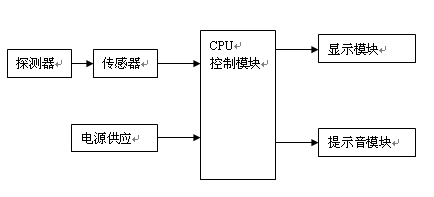
圖1 產品結構框圖
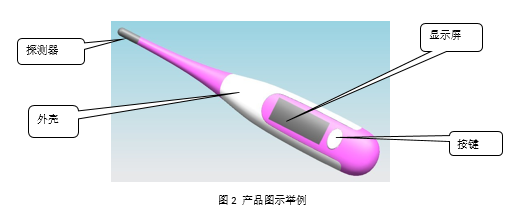
3. 玻璃體溫計
3.1 玻璃體溫計結構組成
通常由玻璃管、感溫泡、汞或其他感溫液體和刻度尺標組成。
3.2 玻璃體溫計工作原理:
采用汞或其他液體的熱脹冷縮原理測量溫度。
3.3 玻璃體溫計產品典型結構:
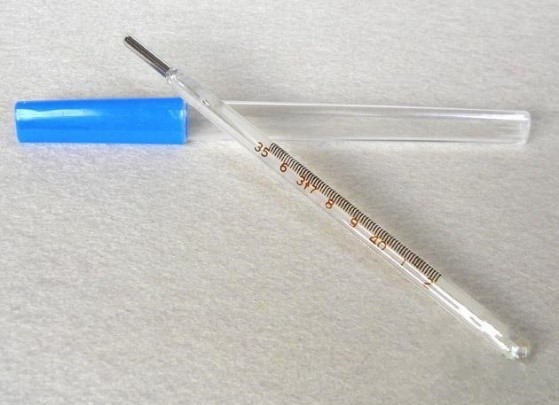
二、體溫計產品分類信息
一級 | 二級 | 三級 | 產品描述 | 預期用途 | 品名舉例 | 管理類別 |
07醫用診察和監護器械 | 03生理參數分析測量設備 | 04體溫測量設備 | 通常由玻璃管、感溫泡、汞或其他感溫液體和刻度尺標組成。采用汞或其他液體的熱脹冷縮原理測量溫度。 | 用于臨床測量患者體溫。通常放置于人體的口腔、腋下、肛門部位測量。 | 玻璃體溫計、體溫計 | Ⅱ |
常由熱電偶或其他接觸式測溫傳感器、顯示單元,供電電路,測量電路組成。將傳感器通過接觸傳導測得的溫度轉換為電信號進行顯示或數據輸出。 | 用于臨床測量患者體溫。通常放置于人體的口腔、腋下、肛門、額頭部位測量。 | 電子體溫計 | Ⅱ | |||
通常由紅外溫度傳感器、探頭套、顯示單元、供電電路、測量電路組成。采用紅外感溫方法測量溫度顯示或者數據輸出。 | 用紅外方法測量臨床測量患者體溫,通常用于測量患者耳道、額頭部位溫度。 | 電子體溫計、額溫計、紅外耳溫計 | Ⅱ |
三、體溫計臨床試驗要求
體溫計產品已經列入免于進行臨床試驗的醫療器械目錄中,可免于進行臨床試驗,注冊申報過程只需要提交臨床評價報告,免于進行臨床試驗的描述如下:
序號 | 分類編碼 | 產品名稱 | 產品描述 | 類別 |
353 | 07-03-04 | 額溫計 | 通常由紅外溫度傳感器、探頭套、顯示單元、供電電路、測量電路組成。采用紅外感溫方法測量溫度顯示或者數據輸出。應提供臨床準確性的臨床驗證資料。 | Ⅱ |
354 | 07-03-04 | 體溫測量設備(無源) | 通常由玻璃管、感溫泡、汞或其他感溫液體和刻度尺標組成。采用汞或其他液體的熱脹冷縮原理測量溫度。用于臨床測量患者體溫。通常放置于人體的口腔、腋下、肛門部位測量。豁免情況不包括使用了新材料、新作用機理、新功能的產品。 | Ⅱ |
355 | 07-03-04 | 醫用電子體溫計 | 醫用電子體溫計為間歇接觸式監控患者體溫的電子裝置,可由塑膠外殼、電路板、溫度測量部件、顯示屏、電源等組成;可按設計、技術參數、附加輔助功能、預期用途等不同分為若干型號,供測量人體體溫或女性監測排卵周期等用,不包括預測模式,也不包括醫用紅外體溫計。產品性能指標采用下列參考標準中的適用部分,如:GB/T 21416-2008 醫用電子體溫計。 | Ⅱ |
356 | 07-03-04 | 耳腔式醫用紅外體溫計 | 耳腔式醫用紅外體溫計可由塑膠外殼、電路板、溫度測量部件、顯示屏、電源、隔離膜等組成;可按設計、技術參數、附加輔助功能、預期用途等不同分為若干型號;通過熱輻射顯示被測人體耳腔體溫。需提供臨床準確度與臨床重復性報告。產品性能指標采用下列參考標準中的適用部分,如:GB/T 21417.1-2008醫用紅外體溫計 第1部分:耳腔式。 | Ⅱ |
四、體溫計技術要求
體溫計技術要求中部分重要性能指標對比
產品類別 | 紅外體溫計 | 電子體溫計 | 玻璃體溫計 |
適用標準 | GB/T 21417.1-2008醫用紅外體溫計 第1部分:耳腔式 | GB/T 21416-2008 醫用電子體溫計 | GB 1588-2001 玻璃體溫計 |
適用的指導原則 | 耳腔式醫用紅外體溫計注冊技術審查指導原則 | 醫用電子體溫計注冊技術審查指導原則 (2017年修訂版) | / |
溫度顯示范圍 | 不窄于35.0℃~42.0℃ | 不窄于35.0℃—41.0℃ | / |
最大允許誤差 | 規定的溫度顯示范圍內最大允許誤差:在35.0℃~42.0℃內,最大允許誤差±0.2℃。 規定的溫度顯示范圍外最大允許誤差:在35.0℃~42.0℃外,最大允許誤差±0.3℃。 變化環境條件下最大允許誤差:應符合本標準6.3.1的要求。 最大允許臨床誤差:臨床重復性不應超過±0.3℃范圍。 | 溫度顯示范圍A低于35.3或高于41.0時,最大允許誤差B±0.3;當A為35.3—36.9或39.1—41.0時,B±0.2;當A為37.0—39.0時,B為±0.1(單位為攝氏度) | 新生兒棒式體溫計示值允差:±0.15℃,其余體溫計示值允差:-0.15/+0.10℃。 |
分辨力 | / | 0.1℃或更小 | 溫度的最小分度值為0.1℃,分度應均勻 |
重復性 | 不應超過±0.3℃ | 重復性誤差S≤0.2℃ | / |
其他 | 見標準GB/T21417.1—2008醫用紅外體溫計第1部分:耳腔式 | 見標準GB/T 21416-2008 《醫用電子體溫計》 | 見標準GB 1588-2001 玻璃體溫計 |
五、體溫計主要參考技術標準或規范
表1紅外體溫計可參考相關標準
標準編號 | 標準名稱 |
GB 9706.1—2007 | 醫用電氣設備第一部分:安全通用要求 |
GB/T 14710—2009 | 醫用電器環境要求及試驗方法 |
GB 15980—1995 | 一次性使用醫療用品衛生標準 |
GB/T16886.1—2011 | 醫療器械生物學評價第1部分:風險管理過程中的評價與試驗 |
GB/T 16886.5—2017 | 醫療器械生物學評價第5部分:體外細胞毒性試驗 |
GB/T 16886.7—2015 | 醫療器械生物學評價第7部分:環氧乙烷滅菌殘留量 |
GB/T 16886.10—2017 | 醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗 |
YY/T 0466.1—2009 | 醫療器械用于醫療器械標簽、標記和提供信息的符號第1部分:通用要求 |
YY 0505—2012 | 醫用電氣設備第1—2部分:安全通用要求并列標準:電磁兼容要求和試驗 |
GB/T21417.1—2008 | 醫用紅外體溫計第1部分:耳腔式 |
YY/T 0664—2008 | 醫療器械軟件軟件生存周期過程 |
YY/T 0708—2009 | 醫用電氣設備第1—4部分:安全通用要求并列標準:可編程醫用電氣系統 |
表2電子體溫計可參考相關標準
標準編號 | 標準名稱 |
GB 9706.1—2007 | 醫用電氣設備第一部分:安全通用要求 |
GB/T 191-2008 | 《包裝儲運圖示標志》 |
GB/T 9969-2008 | 《工業產品使用說明書 總則》 |
GB/T 14710—2009 | 醫用電器環境要求及試驗方法 |
GB/T16886.1—2011 | 醫療器械生物學評價第1部分:風險管理過程中的評價與試驗 |
GB/T 16886.5—2017 | 醫療器械生物學評價第5部分:體外細胞毒性試驗 |
GB/T 16886.10—2017 | 醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗 |
GB/T 21416-2008 | 《醫用電子體溫計》 |
YY/T 0466.1—2009 | 醫療器械用于醫療器械標簽、標記和提供信息的符號第1部分:通用要求 |
YY 0505—2012 | 醫用電氣設備第1—2部分:安全通用要求并列標準:電磁兼容要求和試驗 |
YY/T 0316-2008 | 《醫療器械 風險管理對醫療器械的應用》 |
表3 玻璃體溫計可參考相關標準
標準編號 | 標準名稱 |
GB/T16886.1—2011 | 醫療器械生物學評價第1部分:風險管理過程中的評價與試驗 |
GB/T 16886.5—2017 | 醫療器械生物學評價第5部分:體外細胞毒性試驗 |
GB/T 16886.10—2017 | 醫療器械生物學評價第10部分:刺激與遲發型超敏反應試驗 |
GB 1588-2001 | 《玻璃體溫計》 |
YY/T 0466.1—2009 | 醫療器械用于醫療器械標簽、標記和提供信息的符號第1部分:通用要求 |
YY/T 0316-2008 | 《醫療器械 風險管理對醫療器械的應用》 |
六、體溫計注冊審批時限
國產體溫計產品在一般審批情況下,其注冊審批周期為80工作日(不含補正過程):
- 技術審評:60個工作日,發補后再60個工作日;
- 行政審批:20個工作日。
瑞旭集團提醒各企業,若通過應急審批進行的注冊申報,則技術審評和行政審批時間根據各省規定加快審批,但是應急審批的批件有效期也是有規定,一般期限不會超過1年。
