隨著2020年6月29日《化妝品監督管理條例》發布,國家藥品監督管理局于7月21日對外發布《化妝品注冊管理辦法(征求意見稿)》,現向社會公開征求意見。公眾可通過以下途徑和方式提出反饋意見:
1. 登陸中華人民共和國司法部 中國政府法制信息網(網址:www.moj.gov.cn、www.chinalaw.gov.cn),進入首頁主菜單的“立法意見征集”欄目提出意見。
2. 通信地址:北京市西城區展覽路北露園1號,郵政編碼:100037,并在信封上注明“化妝品注冊管理辦法征求意見”字樣。
3. 電子郵箱:huazhuangpinchu@163.com。
意見反饋截止時間為2020年8月20日。
《化妝品注冊管理辦法(征求意見稿)》(以下簡稱《辦法》)一共7章88條。分為總則、基本要求、化妝品新原料注冊備案管理、化妝品注冊備案管理、監督管理、法律責任、附則。瑞旭集團對《化妝品注冊管理辦法》征求意見稿及《化妝品注冊管理辦法》征求意見稿起草說明中關于化妝品注冊備案管理內容進行整理匯總,并結合多年來產品注冊經驗進行解讀分析。關于《化妝品注冊管理辦法》征求意見稿中對化妝品新原料注冊備案管理的匯總解讀詳見瑞旭解讀《化妝品注冊管理辦法》征求意見稿-化妝品新原料篇。且新原料篇中也羅列了《辦法》中第一章 總則和第二章 基本要求的重點內容。
國家對特殊化妝品實施注冊管理,對普通化妝品實施備案管理。化妝品注冊申請人和備案人需要具備相應的條件。注冊申請人或者備案人為境外企業的,應當指定我國境內的企業法人作為境內責任人,境內責任人也應履行相關義務。可詳見《辦法》中第十條和第十一條內容。
《辦法》中第四章內容為化妝品注冊備案管理(第三十六條至第六十四條),細分為一般要求、備案管理、注冊管理、注冊證延續四塊內容。
1.一般要求(第三十六條至四十四條))
內容涵蓋:原料使用要求、分段生產、進口化妝品要求、套裝產品、委托確認、產品執行的標準、注冊備案檢驗、功效資料、合并分立。與現有注冊備案資料要求相比,修改了原料使用要求,新增產品執行標準以及功效資料。化妝品功效宣稱依據的指導原則由國家藥品監督管理局另行制定發布。
表1 《辦法》中原料使用要求、執行標準及功效資料與現行法規相關要求對比
項目 | 《化妝品注冊管理辦法》征求意見稿 | 現行法規要求 |
原料使用要求 | 明確原料的來源及其原料質量規格,后續原料來源或者原料質量規格發生變化的,應當進行安全評估并更新相關注冊備案信息。 | 僅高風險原料需提供原料質量規格。原料質量規格發生變化,無需更新注冊備案信息。 |
產品執行的標準 | 化妝品注冊人、備案人應當制定擬注冊、備案化妝品的產品執行的標準。普通化妝品執行的標準由備案人辦理備案時向藥品監督管理部門提交,特殊化妝品執行的標準由藥品監督管理部門在注冊時予以審查。 | 無此要求。但需提供產品質量安全控制要求等資料。 |
功效資料 | 化妝品的功效宣稱應當有充分的科學依據。化妝品注冊人、備案人在取得產品功效宣稱的科學依據后,方可申請注冊或辦理備案。 | 僅部分特殊用途化妝品功效宣稱需要提供科學依據,例如防曬指數。 |
2. 備案管理(第四十五條至五十條)
2.1 新品備案流程
進口和國產普通化妝品備案申請流程整理如下:
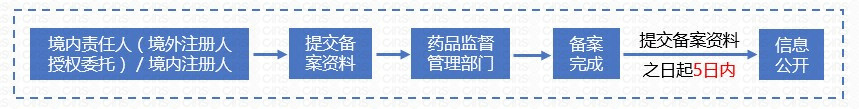
2.2 備案變更、注銷
已備案產品的產品名稱、配方等擬發生變化的,或者因備案人、境內責任人地址變化導致備案管理部門改變的,備案人應當主動注銷原備案信息后重新辦理備案。已備案產品的其它事項擬發生變化的,應當進行備案變更;已備案產品不再生產或者進口的,備案人應當主動注銷備案。
2.3年度報告
普通化妝品辦理備案后,備案人應當每年向承擔備案管理工作的藥品監督管理部門報告產品的生產、進口及不良反應監測情況。
進口非特殊用途化妝品由審批管理改為備案管理時,已提出備案電子信息憑證不再設定有效期,境內責任人應當每年定期通過網上備案系統平臺向化妝品監督管理部門報送已備案產品上一年度的生產或進口、上市銷售、不良反應監測以及接受行政處罰等有關情況。而此次《辦法》中更是強調普通化妝品辦理備案后均有年度報告要求,國產普通化妝品也將被納入管理。
3.注冊管理(第五十一條至六十一條)
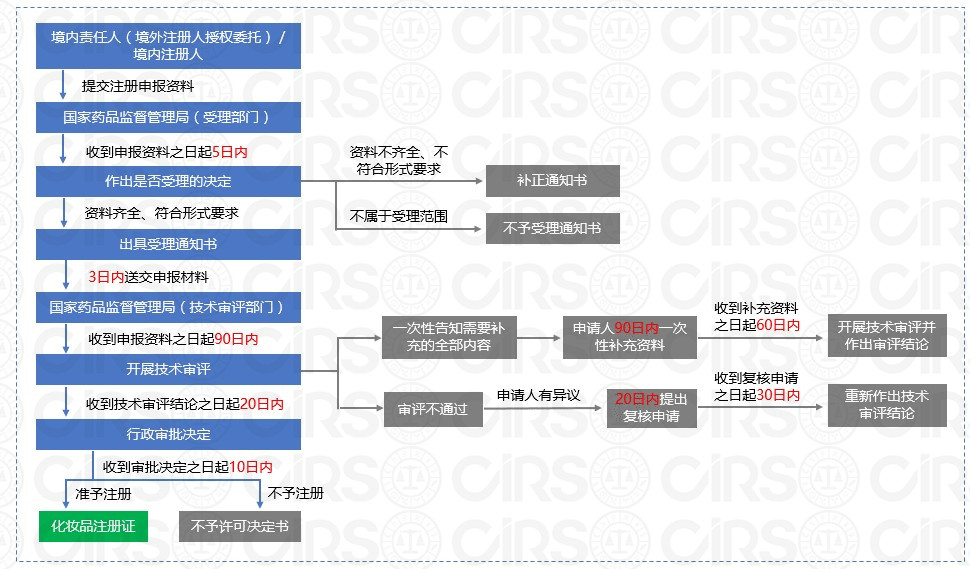
3.1 新品注冊流程
用于染發、燙發、祛斑美白、防曬、防脫發的化妝品以及宣稱新功效的化妝品為特殊化妝品。國家對特殊用途化妝品實施注冊管理。宣稱具有特殊化妝品功效的香皂也適用本辦法。
進口和國產特殊化妝品注冊申請流程整理如下:
3.2 與現有合規要求對比
《辦法》中明確了注冊受理、注冊撤回、注冊變更等的要求,與現行法規有很大差別。
表2《辦法》中特殊化妝品注冊管理與現行法規相關要求對比
項目 | 《化妝品注冊管理辦法》征求意見稿 | 現行法規要求 |
進口特殊化妝品授權委托對象 | 境內責任人 | 在華申報責任單位 |
補充資料時限要求 | 申請人應當在90日內按照要求一次性補充資料,技術審評部門應當在收到補充資料之日起60日內開展技術審評并作出審評結論。 | 申請人一年內按《行政許可技術審查延期通知書》意見提交補充資料,自補充材料全部提交之日起, 專家評審期限延長90 個工作日。 |
復核申請時限要求 | 應當在收到告知之日起20日內提出復核申請。 | 應當在收到《行政許可技術審查意見告知書》之日起30個工作日內提出復核申請。 |
注冊證有效期 | 5年 | 4年 |
上傳銷售包裝 | 特殊化妝品取得注冊后或者銷售包裝擬發生變化的,注冊人應當在產品投放市場前,通過網上注冊平臺上傳與標簽設計樣稿一致的產品銷售包裝(含標簽、說明書)圖片,經省、自治區、直轄市藥品監督管理部門確認后向社會公開。 | 銷售包裝無公示要求。 |
注冊事項變更 | 對產品安全、功效的影響程度實施分類管理。
| 無分類管理,均實施注冊變更申請。進口產品外文名稱不得變更;配方發生變化時,需重新申請注冊;申報系統中無包裝變更事項(包裝標注的防曬指數變更除外)。 |
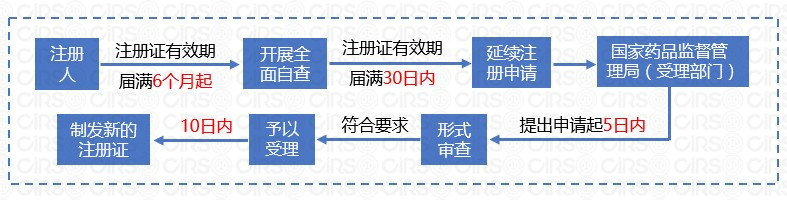
4. 注冊證延續(第六十二條至六十四條)
特殊化妝品注冊證有效期屆滿需要延續的,注冊人應當在產品注冊證有效期屆滿30日前提出延續注冊申請。逾期未提出延續注冊申請的,不再受理。基本申請流程如下:
2019年5月,國家藥品監督管理局為進一步提升審評審批效率,夯實企業主體責任,發布《關于實施特殊用途化妝品行政許可延續承諾制審批有關事宜的公告(2019年 第45號)》。公告給出了化妝品行政許可延續工作要求和化妝品批件延續自查承諾報告樣例。
現行法規,關于化妝品注冊備案管理的相關規定,散落在多個規范性文件中。此次《化妝品注冊管理辦法(征求意見稿)》與新發布的《化妝品監督管理條例》配套,在化妝品注冊備案方面做了系統、完整的規定。除了前文中所總結的一些內容外,《辦法》中其他一些章節的有關化妝品產品的創新制度和監管理念也值得企業關注。
- 注冊備案異常狀態處理(第六十九條)
注冊人、備案人、境內責任人的網上注冊或者備案系統中填報的相關聯系方式需實時更新。藥品監督管理部門無法與用戶取得聯系時,將列為異常狀態。
異常狀態限制使用時,化妝品注冊人、備案人、境內責任人未在規定時間內主動與藥品監督管理部門聯系的,由承擔注冊備案管理工作的藥品監督管理部門注銷其已注冊、備案產品。
- 分級管理(第七十一條)
藥品監督管理部門依據備案人、境內責任人、化妝品生產企業的質量管理體系、備案產品情況、備案后監督情況、產品上市后的監督檢查情況等對其實行動態量化評分,并根據評分情況實施針對性的監管措施。
- 國產和進口(第八十五條)
進口和國產產品的界定取決于化妝品最后一道接觸內容物的工序是在境內完成還是境外完成。在中國臺灣、香港和澳門地區完成的參照進口產品管理。以一個產品名稱注冊的配合使用產品或者組合包裝產品,任何一劑的最后一道接觸內容物的工序在境外完成的,按進口產品管理。化妝品在多個地址分段生產完成的,化妝品注冊人、備案人應當對全過程進行質量管理,申請注冊或者辦理備案時提供完整的生產工藝。
