近日,國家藥品監督管理局發布了2020年修訂版的需進行臨床試驗審批的第III類醫療器械目錄(以下簡稱“臨床審批目錄”),列入臨床審批目錄的醫療器械產品,在中國開展臨床試驗之前需要先通過臨床試驗審批。本文整理總結了臨床試驗審批流程及申報要求,供醫療器械企業參考學習。
醫療器械臨床試驗技術咨詢聯系方式:0571-87206527 或010-83123902,md@cirs-group.com.
1. 哪些醫療器械將納入臨床試驗審批目錄?
與境內外已上市產品相比,采用全新設計、材料或機理適用于全新適用范圍,且對人體具有較高風險的醫療器械將納入臨床試驗審批目錄。臨床試驗審批目錄動態管理,由國家藥品監督管理局制定、調整并公布,最新實施的臨床試驗審批目錄于2020年9月14日發布并實施,目錄見文末附件。
2. 臨床試驗審批流程
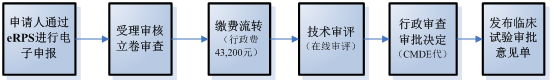
醫療器械臨床試驗審批執行默示許可制,既自臨床試驗審批申請受理并繳費之日起60個工作日內,申請人在預留聯系方式、郵寄地址有效的前提下,未收到器審中心意見(包括專家咨詢會議通知和補充資料通知)的,可以開展臨床試驗。
3. 臨床試驗審批審評意見有哪些?
- 專家咨詢
- 補正資料
- 聯合審評
- 準予開展臨床試驗
- 不予批準開展臨床試驗
4. 臨床試驗審批申報資料要求
序號 | 資料要求 | |
1 | 申請表 | |
2 | 證明性文件 | 境內申請人:企業營業執照及組織機構代碼證;境外企業:原產國批準的產品上市銷售證明及中國境內代理人委托書及代理人資質證明 |
3 | 與評價試驗用醫療器械安全性和有效性相關的已發表文獻及評論性綜述。 | |
4 | 綜述資料 | 應當包括試驗用醫療器械的設計原理、工作原理、產品特征、結構組成及圖示、制造材料、包裝材料、型號規格及其劃分依據、主要生產工藝、交付狀態、作用機理、適用范圍等內容 |
5 | 國內外同類產品研發、上市及臨床應用情況及試驗用醫療器械與國內外已上市同類產品在工作原理、結構組成、制造材料、技術參數及適用范圍等方面的異同比較資料。 | |
6 | 風險分析報告 | |
7 | 產品技術要求 | |
8 | 檢測報告 | 醫療器械檢驗機構出具的檢驗報告和預評價意見。 |
9 | 臨床試驗方案及方案合理性的分析資料 | 臨床試驗方案應當符合國家食品藥品監督管理總局發布的《醫療器械臨床試驗質量管理規范》相關要求,并提交證明臨床試驗方案科學合理性的分析資料。 |
10 | 倫理委員會同意臨床試驗開展的書面意見 | 在多中心開展臨床試驗的,應當提交牽頭單位倫理委員會同意臨床試驗開展的書面意見;在非多中心開展臨床試驗的,應當提交全部臨床試驗機構的倫理委員會同意臨床試驗開展的書面意見。 |
11 | 包裝標簽 | |
12 | 說明書 | |
13 | 不良事件信息 | |
14 | 符合性聲明 | 申請人聲明本產品符合《醫療器械注冊管理辦法》和相關法規的要求及所提交資料的真實性。 |
5. 醫療器械臨床試驗審批意見單主要內容
- 受理號 ()
- 申請人名稱
- 申請人住所
- 試驗用醫療器械名稱
- 試驗用醫療器械型號、規格
- 試驗用醫療器械結構及組成
- 審批意見
- 備注 (eRPS系統通知申請人)
附件:需進行臨床試驗審批的第三類醫療器械目錄(2020年修訂版)
序號 | 產品類別 | 分類編碼 | 產品描述 |
1 | 植入式心臟節律管理設備 | 12 | 植入式心臟起搏器:通常由植入式脈沖發生器和扭矩扳手組成。通過起搏電極將電脈沖施加在患者心臟的特定部位。用于治療慢性心率失常。再同步治療起搏器還可用于心力衰竭治療。 植入式心臟除顫器:通常由植入式脈沖發生器和扭矩扳手組成。通過檢測室性心動過速和顫動,通過電極向心臟施加心律轉復/除顫脈沖對其進行糾正。用于治療快速室性心律失常。再同步治療除顫器還可用于心力衰竭治療。 |
2 | 植入式心室輔助系統 | 12 | 通常由植入式泵體、電源部分、血管連接和控制器組成。用于為進展期難治性左心衰患者血液循環提供機械支持,用于心臟移植前或恢復心臟功能的過渡治療和/或長期治療。供具備心臟移植條件與術后綜合護理能力的醫療機構使用,醫務人員、院外護理人員以及患者須通過相應培訓。抗凝治療不耐受患者禁用。 |
3 | 植入式藥物輸注設備 | 12 | 通常由藥物灌注泵、再灌注組件和導管入口組件組成。該產品與鞘內導管配合使用,進行長期藥物的輸入。 |
4 | 人工心臟瓣膜和血管內支架 | 13 | 人工心臟瓣膜或瓣膜修復器械:一般采用高分子材料、動物組織、金屬材料、無機非金屬材料制成,可含或不含表面改性物質。用于替代或修復天然心臟瓣膜。 血管內支架:支架一般采用金屬(包括可吸收金屬材料)或高分子材料(包括可吸收高分子材料)制成,其結構一般呈網架狀。支架可含或不含表面改性物質,如涂層。可含有藥物成分。如用于治療動脈粥樣硬化、以及各種狹窄性、阻塞性或閉塞性等血管病變。 |
5 | 含活細胞的組織工程醫療產品 | 13/16/17 | 以醫療器械作用為主的含活細胞的無源植入性組織工程醫療產品。 |
6 | 可吸收四肢長骨內固定植入器械 | 13 | 采用可吸收高分子材料或可吸收金屬材料制成,適用于四肢長骨骨折內固定。 |
