臨床試驗-醫療器械臨床試驗數據遞交要求
為加強醫療器械產品注冊工作的監督和指導,器審中心于2021年年末發布了《醫療器械臨床試驗數據遞交要求注冊審查指導原則》正式版本,本文整理出醫療器械臨床試驗最終需要遞交的文件清單及遞交要求供有需求企業參考,在數據庫和原始代碼的提交上也可參考瑞旭-西爾思往期文章醫療器械臨床試驗管理規范FAQ(四)-醫療器械臨床試驗數據遞交要求及常見問題分析。
1、醫療器械臨床試驗數據遞交資料及要求
臨床實驗數據遞交基本原則:真實、可追溯、可讀 | ||||
遞交資料 | 資料內容 | 遞交要求 | 解讀 | 遞交形式 |
原始數據庫 | 病例報告表
| 數據集和變量命名應遵循“可讀性”的原則,建議在對其命名時參考數據集或變量的英文或拼音,使得通過名稱可較容易聯想到該命名的實際含義 | 解讀: ① 這里并未對數據集的字母個數和大小寫進行限制,并加多了拼音這一命名方式,比如電腦驗光(computerized optometer)可以命名為COOP或DNYG。 ② 并未對標識變量和訪視變量進行強制的要求,變量大小寫也沒有要求,可以自由命名,只要以字母為開頭即可,如受試者姓名縮寫可以命名為SubIN或SSZXMSX,這也符合“易讀”的原則。 ③ 對于變量命名建議可以參照藥物臨床遞交要求統一標準化規則。 | XPT (V5) |
外部文件中直接收集的原始數據 | ||||
分析數據庫 | 原始數據庫中的變量數據 | 分析數據集變量命名同原始數據庫要求。 | XPT (V5) | |
按照臨床試驗方案和統計分析計劃中事先確定的方法從原始數據庫變量數據衍生的數據。 | ||||
遞交資料 | 資料內容 | 遞交要求 | 解讀 | 遞交形式 |
程序代碼 | 用于原始數據庫生成分析數據庫的代碼 | 遞交的代碼應符合通常的編程格式和編程規范,結構清晰明了,易于閱讀。程序代碼中應包括充分的注釋,以描述不同程序代碼的目的及其他需解釋的內容,幫助審閱者更好地理解代碼邏輯。 如果遞交的程序代碼引用了宏程序,需提供相應的宏程序代碼,并說明運行該程序的軟件版本、系統環境。 | ① 應避免提交復雜嵌套的宏程序,如果提交了復雜嵌套的宏程序,應充分驗證以確保在不同的計算機系統環境中均可運行該程序。 ② 涉及到代碼的分析和處理過程都需要進行遞交,支持復雜的宏程序,并且是可執行的。 | TXT |
分析數據庫生成統計分析結果的代碼
| ||||
說明性文件 | 數據說明文件
| 建議采用Excel文件,以表格的形式分別列明原始數據庫和分析數據庫中所含的數據集、變量、變量類型(如字符型、數值型)、標簽、賦值及其對應關系 | Word Excel等 | |
程序代碼使用說明文件 | 以表格形式逐一列明生成各統計結果圖表所使用到的程序代碼文件和數據集文件名稱。 注冊申請人應說明原始數據集和分析數據集所用編碼(如UTF-8、EUC-CN等),以避免所遞交的數據集出現亂碼的情形。 | |||
注釋病例報告表 | CRF中可能收集了一些與臨床試驗結果分析無關的冗余數據,這些數據可不包含在遞交的數據庫中,但應在注釋CRF上明確標注為“不遞交”,并闡明理由。 | |||
其他說明性文件 | 除以上說明性文件外,鼓勵注冊申請人提交其他有利于審閱者快速了解臨床試驗數據庫內容和結構的說明性文件(如概覽性文件、其他特殊情況說明文件等)。 | |||
2、醫療器械數據遞交文件夾結構
遞交文件夾結構
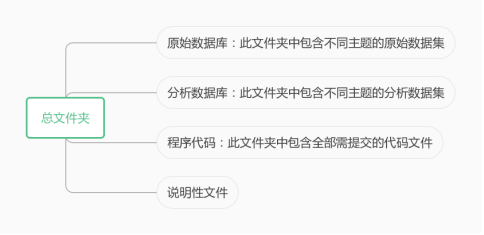
往期文章:
