醫療器械臨床試驗的坑,90%藏在細節里,本文通過拆解臨床試驗四大高頻翻車現場,并分享瑞旭CRO獨家“0缺陷”通過稽查實操經驗。
醫療器械臨床試驗“避坑”一:原始記錄修改,但切記不要回簽日期,因為所有記錄都留痕,稽查老師秒發現。
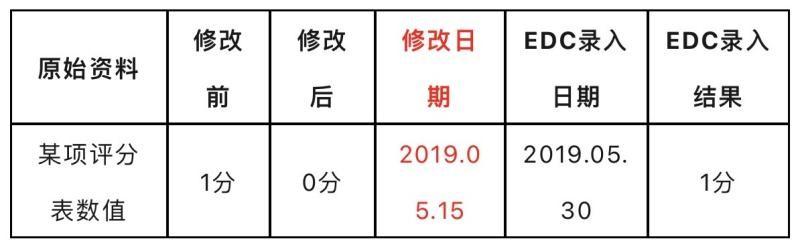
案例重現:如下圖,原始資料中示該數據于2019.05.15修改,EDC錄入日期為2019.05.30,但仍錄入修改前的錯誤數據。若該問題被稽查人員發現了,回簽行為實錘。不知道多少人關注過EDC中數據的操作痕跡,如果你去看看EDC的操作痕跡,你就會發現數據修改日期存在回簽現象。
瑞旭建議“時空校驗”SOP,任何修改,系統自動凍結,確認后再統一解鎖,徹底告別回簽風險。
夫妻或家庭成員同時入組醫療器械臨床試驗行不行? 根據醫療器械臨床試驗法規,所有患者/健康志愿者均有參加臨床試驗的機會;選擇招募對象時,應充分考慮其承擔的研究風險和獲益; 因此醫療器械臨床試驗.法規中并未明確不允許同一家庭多人參與同一臨床試驗,所有人都有參加臨床試驗的權利,只要滿足方案的要求均可入選臨床試驗,大的原則是考慮受試者的收益風險比。
夫妻或家庭多人入組同一臨床試驗,容易破盲,最終導致數據報廢,瑞旭建議建立“親屬矩陣”篩查:同地址、同聯系人、同IP一鍵預警。
法規沒有確說明知情同意書誰先簽署?在臨床試驗過程需要考慮以下問題:
1. 從項目管理角度上思考:若受試者不同意參加試驗,醫生簽署的知情同意書怎樣管理?是否造成知情同意書浪費情況。
2. 從受試者權益角度思考:研究者先簽署,是否會對受試者造成一定的心里壓力。
3. 從簽署規范及真實性思考:知情同意書作為證明文件,若未當面簽署,無法確定簽字是否是受試者本人簽署。
瑞旭建議應“面對面簽署”,受試者和研究者簽署時間間隔時間不宜過久,且病例中需要詳細描述知情同意過程。
研究者覺得手寫累使用簽名章,但是法規卻只認“可溯源”。
臨床試驗中的源文件,參照法規,即研究者提供的所有醫學報告、記錄和文件都是可溯源的、清晰的、同步記錄的、原始的、準確的和完整的、注明日期和試驗編號的。如果使用簽名章,需要考量的因素有:簽名章的保管是否嚴格受控、簽名章的使用是否可以完全代表簽名章本人意愿、簽名章的使用是否符合研究中心的臨床實踐、簽名章的模式是否在研究人員授權表上記錄等。
如果使用電子簽名,參照法規,電子簽名同時符合下列條件的,視為可靠的電子簽名:
(一)電子簽名制作數據用于電子簽名時,屬于電子簽名人專用。
(二)簽署時電子簽名制作數據僅由電子簽名人控制。
(三)簽署后對電子簽名的任何改動能夠被發現。
(四)簽署后對數據電文內容和形式的任何改動能夠被發現。
當事人也可以選擇使用符合其約定的可靠條件的電子簽名。可靠的電子簽名與手寫簽名或者蓋章具有同等的法律效力。 因各個中心對醫療文件的歸檔儲存有不同要求,在參考以上法規的同時,也要結合各個中心實際情況。
一條回簽、一次破盲、一張廢ICF,足以讓項目暫停,預算翻倍,臨床稽查不會提前打招呼,臨床試驗應提前做好規劃,把合規寫進SOP,把成功寫進注冊證。
